Por Graziele Souza
O papel da Agência Nacional de Vigilância Sanitária, Anvisa, é principalmente, a proteção da saúde da população, por meio do controle sanitário da produção e consumo de produtos e serviços submetidos à vigilância sanitária, incluindo os ambientes, os processos, os insumos e as tecnologias a eles relacionados. Também é responsável pelo controle dos portos, aeroportos, fronteiras e nas alfândegas.
Processo de regulamentação de um medicamento
Como é o processo até que um medicamento seja aprovado pela Anvisa?
Para que um medicamento esteja no mercado ele precisa estar autorizado pela Anvisa. O processo começa com a apresentação de um pedido de registro feito pelo laboratório produtor. A partir daí a Anvisa vai analisar os estudos apresentados para decidir se o produto pode estar no mercado.
Dessa forma, se um medicamento não está no mercado brasileiro isso acontece por uma das quatro situações abaixo:
- O produto não comprovou eficácia e segurança e por isso o pedido foi indeferido;
- Nenhum pedido de registro foi apresentado à Anvisa;
- A substância faz parte de uma lista de produtos banidos por falta de segurança ou proibição legal (exemplo: anfetamínicos, LSD etc.);
- O medicamento ainda está em análise na Anvisa.
Ver figura abaixo:
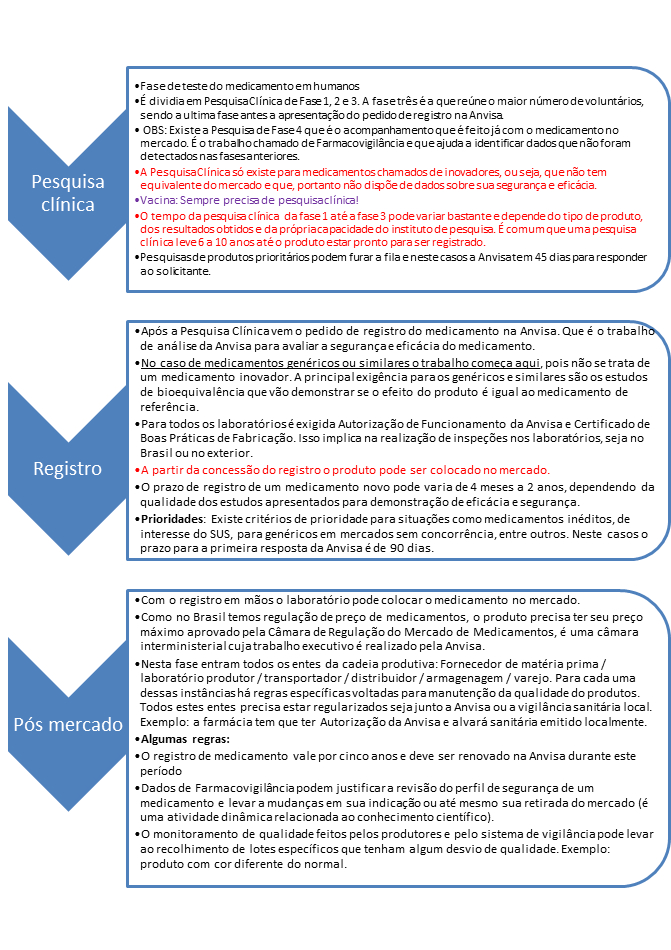
Fonte: Anvisa
Quando certas substâncias ganham atenção da mídia, e se tornam midiatizadas isso é bom ou atrapalha o processo de análise?
Para a Anvisa não há interferência, pois, como mostrado acima, é uma análise técnica.
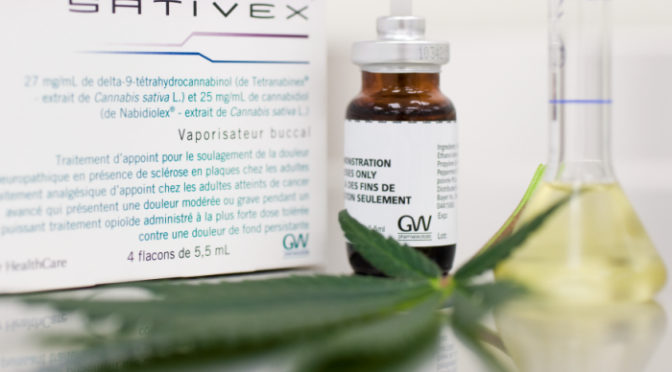
Produtos e medicamento à base de Cannabis sativa
No dia 5 de dezembro de 2016 a Anvisa aprovou a importação por pessoas físicas de uma lista de produtos à base de canabidiol, derivado da maconha, para uso próprio e de maneira mais simples. Na época a lista com permissão de importação continha 7 novos produtos, quase todos produzidos nos Estados Unidos. Os que precisam de acesso desses produtos derivados de maconha precisam ter prescrição médica e a indicação da opção de tratamento, sendo emitido a autorização excepcional com validade de um ano. Já no início desse ano, a Agência aprovou o registro do primeiro medicamento no Brasil à base da maconha, o Meyatyl.
Como está o processo de regulamentação do medicamento à base de Cannabis sativa?
Uma atualização na lista A3 presente no anexo I da Portaria SVS/MS nº 344/98, que indica as plantas e substâncias sob controle especial no Brasil, possibilitou a inclusão de medicamentos registrados pela Anvisa derivados da Cannabis sativa, em concentração de no máximo 30 mg de tetrahidrocannabinol (THC) por mililitro e 30 mg de canabidiol por mililitro.
A atualização foi motivada pela fase final do processo de registro do medicamento Mevatyl®, pois ele é obtido da planta Cannabis sativa L., e possui as substâncias canabidiol e tetrahidrocannabinol em sua composição. Esse medicamento será usado para o tratamento de sintomas de pacientes adultos com espasticidade moderada a grave devido à esclerose múltipla (EM), e será comercializado com as regras de prescrição que também são usados para os medicamentos entorpecentes e psicotrópicos de uso médico. Além de ter um receituário especial, a Anvisa terá um sistema especial de monitoramento no qual constará o registrado dos dados de quem prescreve e do comprador.
“Atualizamos a portaria exatamente para que, se o registro for concedido, os médicos saibam como esse medicamento será prescrito”, diz o diretor-presidente da Anvisa, Jarbas Barbosa. “Assim, o medicamento será prescrito da mesma forma que outros medicamentos psicotrópicos já em uso no Brasil. Ou seja, terá a tarja preta e só poderá ser vendido com prescrição médica especial, que é aquele formulário que o médico tem, numerado. Quando vendido, a farmácia terá a obrigação de registrá-lo no Sistema Nacional de Controle de Medicamentos, que é gerenciado pela Anvisa, para que possamos monitorar se há está havendo algum desvio ou abuso na sua prescrição”.
Vale ressaltar que o Mevatyl não é indicado para o tratamento de epilepsia, pois o THC, uma de suas substâncias ativas, apresenta potencial de causar agravamento de crises epiléticas. O medicamento também não é recomendado para uso em crianças e adolescentes com menos de 18 anos de idade devido à ausência de dados de segurança e eficácia para pacientes nessa faixa etária.
Segundo a Anvisa o medicamento Mevatyl está em processo de registro, ainda não concluído. Portanto, até o momento não há nenhum produto disponível para venda no país à base de substâncias derivadas da planta Cannabis sativa L.
Link da Anvisa sobre a norma que permite o registro de medicamento à base de Cannabis sativa.
Link também da Anvisa sobre o registro do primeiro medicamento à base de Cannabis sativa.
Quais são as diferenças entre o medicamento à base de Cannabis sativa, que está em processo de regulamentação, para os outros medicamentos à base de canabidiol, que vêm sendo importados, excepcionalmente, por pessoas físicas?
O processo de regulamentação do primeiro medicamento à base de Cannabis Sativa foi finalizado pela Anvisa e resultou na publicação do registro do novo medicamento Mevatyl.
As diferenças do Mevatyl em relação aos produtos à base de canabidiol, os quais que vêm sendo importados por pessoas físicas de forma excepcional, segundo a Agência abrangem desde sua regularidade no país até sua composição.
O Mevatyl é um medicamento regular, registrado na Anvisa após avaliação de estudos de segurança e eficácia, o que inclui a necessidade de apresentação de estudos clínicos pela empresa que pretende ser titular do registro do produto. Apresenta em sua composição o tetraidrocanabinol (THC) e o canabidiol (CBD) – THC: 27 mg/mL e CBD: 25 mg/ml. É indicado para o tratamento sintomático da espasticidade moderada a grave relacionada à esclerose múltipla, sendo destinado a pacientes adultos não responsivos a outros medicamentos antiespásticos.
Já os produtos à base de canabidiol, importados por pessoas físicas de forma excepcional, não apresentam registro aprovado perante a Anvisa. São produtos à base de canabidiol em associação com outros canabinóides, dentre eles o THC, mas podem apresentar variações em sua composição, a depender do fabricante. Por isso, a forma de aquisição desses produtos continua sendo por meio da importação excepcional por pessoa física, para uso próprio, mediante prescrição de profissional legalmente habilitado, para tratamento de saúde, conforme procedimento estabelecido pela RDC n° 17/2015.
A Anvisa ressalta que esses produtos, ao contrário do Mevatyl, não podem ser classificados como medicamentos pois nunca tiveram sua eficácia e segurança avaliada por nenhuma autoridade sanitária competente no mundo. Já o Mevatyl está aprovado em outros 28 países, incluindo Canadá, Estados Unidos, Alemanha, Dinamarca, Suécia, Suíça e Israel.
O medicamento Mevatyl tem registro válido perante a Anvisa, e, portanto, está autorizada sua comercialização no Brasil desde que atendidas as exigências previstas na legislação.
Fosfoetanolamina, a “pílula do câncer”
A conhecida pílula do câncer, fosfoetanolamina, vêm se tornando o tema de várias discussões e polêmicas nos últimos anos em relação aos seus efeitos. Anvisa afirma que a fosfoetanolamina jamais passou por estudo clínico para comprovar sua eficácia e segurança. E nem ao menos solicitou uma solicitação de registro na Agência, assim como todos os medicamentos que estão sendo comercializados no Brasil. Mais recentemente ela vem sendo fabricada e importada dos EUA como suplemento alimentar.
Qual a posição da Anvisa referente as cápsulas da fosfoetanolamina, conhecido como a “pílula do câncer”?
Segundo a Agência a liberação de substâncias que não cumprem com as exigências regulatórias se tornam um risco sanitário. Por não ter informações como a data de validade e fabricação ou até mesmo a bula, isso acaba dificultando a verificação da ocorrência de falsificação das substâncias.
Além de não poder assegurar a rápida suspensão do medicamento ou um de seus lotes caso ocorresse efeitos colaterais ou eventos adversos importantes, pois não haveria o que é chamado pela Organização Mundial de Saúde (OMS) de farmacovigilância, “a ciência e atividades relativas à identificação, avaliação, compreensão e prevenção de efeitos adversos ou quaisquer problemas relacionados ao uso de medicamentos”. Em suma a farmacovigilância tem como objetivo garantir que os benefícios relacionados ao uso desses produtos sejam maiores que os riscos por eles causados.
Para comprovar a eficácia e segurança de um medicamento é indispensável que teste clínicos sejam realizados. Conforme a divulgação da Anvisa, “abrindo mão disso, o Brasil estaria regressando para décadas atrás e sairia do território da comprovação de alegações de cura baseadas em evidências científicas”.
A Agência afirma que “toda solicitação nesse sentido que for apresentada à Anvisa terá prioridade de análise, já que se encaixaria no critério de priorização como medicamento novo desenvolvido no Brasil”.
Porém com a Lei nº 13.269 haveria uma exceção para a “pílula do câncer”, sendo que, seus produtores poderiam informar que a substância fosfoetanolamina cura câncer sem que nenhum estudo tenha comprovado tal capacidade.
Alguns defensores da fosfoetanolamina afirmam que a substância funcione melhor diante da interrupção do uso da quimioterapia. E de acordo com a Anvisa esses fatores se somados poderiam aumentar o abandonando da quimioterapia, causando, inclusive o aumento das mortes por câncer no Brasil.
Link da Anvisa sobre a fosfoetanolamina.
Essa substância passou a ser fabricada nos EUA e vendida como suplemento alimentar pela internet para o Brasil, diante disso qual o papel da Anvisa nesse processo? Seria possível barrar a entrada das cápsulas no Brasil?
Conforme informou a Anvisa “a legislação permite que o produto seja importado por pessoas físicas”, mas não deu mais detalhes sobre a questão.